医薬品リスク管理計画(RMP:Risk Management Plan) 独立行政法人 医薬品医療機器総合機構
医薬品・医療機器・再生医療等製品の承認審査・安全対策・健康被害救済の3つの業務を行う組織。
くすりQ&A
患者向医薬品ガイド
ワクチン接種を受ける人へのガイド
一般用医薬品/要指導医薬品の添付文書
PMDAからの医薬品適正使用のお願い
緊急安全性情報/安全性速報(患者向け)
重篤副作用マニュアル
患者・一般の方からの相談窓口
医薬品副作用被害救済制度
医薬品副作用被害救済制度相談窓口
医療機器Q&A
PMDAからの医療機器適正使用のお願い
患者・一般の方からの相談窓口
くすり・医療機器の承認情報
患者からの医薬品副作用報告
患者副作用報告Q&A
報告いただいた患者副作用報告に関する情報
医療用医薬品の添付文書
一般用医薬品の添付文書
医療機器の添付文書
再生医療等製品の添付文書
体外診断用医薬品の添付文書
医薬品リスク管理計画(RMP)
医薬関係者からの報告
副作用が疑われる症例報告に関する情報
不具合が疑われる症例報告に関する情報
重篤副作用疾患別対応マニュアル(医療従事者向け)
医薬品副作用被害救済制度
医薬品副作用被害救済制度に関するQ&A
請求に必要な書類
医療安全情報
医療用医薬品の審査報告書
一般用医薬品・要指導医薬品の審査報告書
医療機器の審査報告書
新医薬品の承認品目一覧
新医療機器の承認品目一覧
「医療上の必要性の高い未承認薬・適応外薬検討会議」における検討結果を受け保険適用される品目に関する情報
コンパニオン診断薬等の情報
治験関連情報
人道的見地から実施される治験情報(医薬品、機器・再生)
治験審査委員会(IRB)
医薬品/再生医療等製品の信頼性保証業務
医療機器の信頼性保証業務
患者向医薬品ガイド
ワクチン接種を受ける人へのガイド
緊急安全性情報・安全性速報(患者向け)
PMDAからの医薬品適正使用のお願い(患者向け)
医薬品副作用被害救済制度(一般の方向け)
重篤副作用疾患別対応マニュアル(患者・一般の方向け)
PMDAメディナビ
ガイダンス・ガイドライン
ICHガイドライン
実用化までの流れとPMDAの関わる業務
RS総合相談・RS戦略相談
ICHガイドライン
ガイダンス・ガイドライン
実用化までの流れとPMDAの関わる業務
RS総合相談・RS戦略相談
承認基準、認証基準
実用化までの流れとPMDAの関わる業務
RS総合相談・RS戦略相談
製造販売手順及び承認審査に関する情報
再生医療等安全性確保法に関する適合性調査
実用化までの流れとPMDAの関わる業務
RS総合相談・RS戦略相談
開発・承認申請に関する通知等
コンパニオン診断薬について
承認情報
医薬品リスク管理計画(RMP)
日本薬局方
添付文書等の製品に関する情報
治験関連情報
治験審査委員会(IRB)
信頼性保証業務
レギュラトリーサイエンスとは
科学委員会
連携大学院
革新的医薬品・医療機器・再生医療等製品実用化促進事業
PMDAにおけるレギュラトリーサイエンス研究
製造販売手順について
治験関連情報
信頼性調査(GLP/GCP/GPSP適合性調査)
GMP/QMS/GCTP適合性調査
申請等の手続き
承認情報
原薬等登録原簿(マスターファイル)(MF)
輸出証明
外国製造業者の手続き
GMP適合性調査
GCTP適合性調査
指摘事項の公表やGMPラウンドテーブル会議について
GMP・GCTP適合性調査に関するFAQ
RS総合相談・RS戦略相談
治験相談(医薬品・医薬部外品)
治験相談(医療機器・体外診断用医薬品)
治験相談(再生医療等製品)
簡易相談(一般用医薬品・要指導医薬品、医薬部外品等)
ガイダンス・ガイドライン
副作用、不具合等の報告
安全対策の検討・実施に関する相談
添付文書等の情報(医薬品)
添付文書等の情報(医療機器)
添付文書等の情報(再生医療等製品)
添付文書等の情報(体外診断用医薬品)
安全性に関する情報(医薬部外品・化粧品)
医薬品リスク管理計画(RMP)
新医薬品の申請電子データ提出
先駆け審査指定制度
科学委員会
MIHARI Project
審査等手数料・対面助言等の手数料
安全対策等拠出金
副作用拠出金及び感染拠出金
実用化までの流れ
新医薬品(医療用医薬品)の承認審査
新医薬品の承認情報
新医薬品の申請電子データ提出
先駆けパッケージ戦略への対応
実用化までの流れ
バイオ後続品の承認審査
実用化までの流れ
ジェネリック医薬品の承認審査について
日本薬局方について
実用化までの流れ
一般用医薬品・要指導医薬品の承認審査
一般用医薬品・要指導医薬品の承認情報
医薬品の安全対策の流れ
MIHARI Project
医療用医薬品添付文書
患者向医薬品ガイド
医薬品リスク管理計画(RMP)
医薬品の安全対策の流れ
MIHARI Project
ジェネリック医薬品の品質情報
医療用医薬品添付文書
患者向医薬品ガイド
医薬品リスク管理計画(RMP)
医薬品の安全対策の流れ
一般用医薬品・要指導医薬品添付文書
一般用医薬品の販売サイト一覧(厚生労働省サイト)
医薬品副作用被害救済制度の概要
指摘事項の公表やGMPラウンドテーブル会議について
GMP・GCTP適合性調査に関するFAQ
製造販売承認までの流れ
医療機器の審査について
大臣承認の医療機器の審査の概要
第三者認証について
第三者認証品目リスト
届出手続き等について
安全対策の流れ
企業からの不具合報告について
医療従事者からの不具合報告について
生物由来製品感染等被害救済制度の概要
医薬部外品の審査等について
申請の手続き
簡易相談
PMDAが実施するGMP適合性調査業務の範囲
GMP適合性調査
医薬部外品・化粧品の注意喚起情報
医薬部外品の承認情報
医薬部外品・化粧品の副作用等の報告(企業向け)
医薬部外品・化粧品の安全対策に関する相談(企業向け)
輸出証明
製造販売承認までの流れ
製造販売手順及び承認審査について
RS総合相談・RS戦略相談
治験とは
治験届出制度
再生医療等製品の承認審査
GCTP適合性調査
承認情報
安全対策の流れ
企業からの不具合報告について
医療従事者からの不具合報告について
医薬品副作用被害救済制度の概要
生物由来製品感染等被害救済制度の概要
再生医療等安全性確保法に関する適合性調査の概要
科学委員会:CPC(Cell Processing Center)専門部会
科学委員会:細胞組織加工製品専門部会
革新的医薬品・医療機器・再生医療製品実用化促進事業
「RMP提出品目一覧」から探す
「医療用医薬品 情報検索」から探す 情報検索ページでRMPを検索できます。 詳細な検索方法は情報検索機能の使い方868.84KBをご覧ください。
RMPとは
医薬品の安全性の確保を図るためには、開発の段階から市販後に至るまで常にリスクを適正に管理する方策を検討することが重要です。医薬品リスク管理計画(以下、RMP)は、医薬品の開発から市販後まで一貫したリスク管理をひとつの文書に分かり易くまとめ、調査・試験やリスクを低減するための取り組みの進捗に合わせて、または、定期的に確実に評価が行われるようにするものです。また、RMPを公表して、医療関係者の皆様と市販後のリスク管理の内容を広く共有することで、市販後の安全対策の一層の充実強化が図られることが期待されます。
RMP解説資料 RMPについて分かりやすく解説した資料を以下に掲載しております。
『3分でわかる!RMP講座』 RMPについて解説したA4 1枚の資料です。ダウンロードの上、ぜひご活用ください。「3分でわかる!RMP講座」1.27MB
『今日からできる!How to RMP』 RMPおよび追加のリスク最小化活動のために作成・提供される資材について、病院薬剤師の先生が動画で解説しているe-ラーニングコンテンツです。「RMPってなに?編」と「RMPを使ってみよう!編」の2つがあり、どなたでも無料でご覧いただけます。
- RMPってなに?編 RMP及び追加のリスク最小化活動のために作成・提供される資材の基本的事項について 解説しています。資料はこちら3.12MB。
【チャプター】リンクをクリックすると各チャプターのところから閲覧可能です。 なお、動画は別ウィンドウにて再生されます。
- イントロダクション
- 医薬品リスク管理計画(RMP)とは?
- RMPには何が書いてある?
- RMPを読んでみよう!
- RMPのライフサイクル
- まとめ
- RMPを使ってみよう!編 RMPの実際の医療現場での活用方法について、具体例を交え紹介しています。資料はこちら2.25MB。
【チャプター】リンクをクリックすると各チャプターのところから閲覧可能です。 なお、動画は別ウィンドウにて再生されます。
- イントロダクション
- 新しい薬を扱うとき
- 服薬指導を行うとき
- 副作用が疑われたとき
- 実際の活用事例(応用編)
- 最後に
「今日からできる!How to RMP」の広報にご協力いただける方はこちら。 「3分でわかる!RMP講座」「今日からできる!How to RMP」に関するお問い合わせ先 電子メール: medinavi-adatpmda.go.jp (注)迷惑メール防止対策をしているため、 atを半角のアットマークに置き換えてください。
目的
これまでもICH E2Eガイドラインでは、医薬品の既知のリスクや未知のリスク等を要約して「安全性検討事項」として取り上げ、医薬品安全性監視計画を作成するように求めていましたが、医薬品のリスクを低減するための方法については記載されていませんでした。 平成24年4月に、医薬品安全性監視計画に加えて、医薬品のリスクの低減を図るためのリスク最小化計画を含めた医薬品リスク管理計画(RMP: Risk Management Plan)を策定するための指針「医薬品リスク管理計画指針について」314.26KBがとりまとめられ、その後、具体的な計画書の様式、提出などの取扱いについて、「医薬品リスク管理計画の策定及び公表について」255.67KBで示されています。 この指針の活用により医薬品の開発段階、承認審査時から製造販売後の全ての期間において、ベネフィットとリスクの評価・見直しが行われ、これまで以上により明確な見通しを持った製造販売後の安全対策の実施が可能となることを目的としております。
概念図
RMPの中で、安全性検討事項(重要な特定されたリスク、重要な潜在的リスク、重要な不足情報)が設定され、各安全性検討事項に対して、医薬品安全性監視活動とリスク最小化活動の計画が策定されます。医薬品安全性監視活動とリスク最小化活動の実施状況や報告内容に基づいて、ベネフィット・リスクバランスが評価され、必要に応じてRMPの見直しが行われます。RMP全体のイメージを示した画像は以下のとおりです。
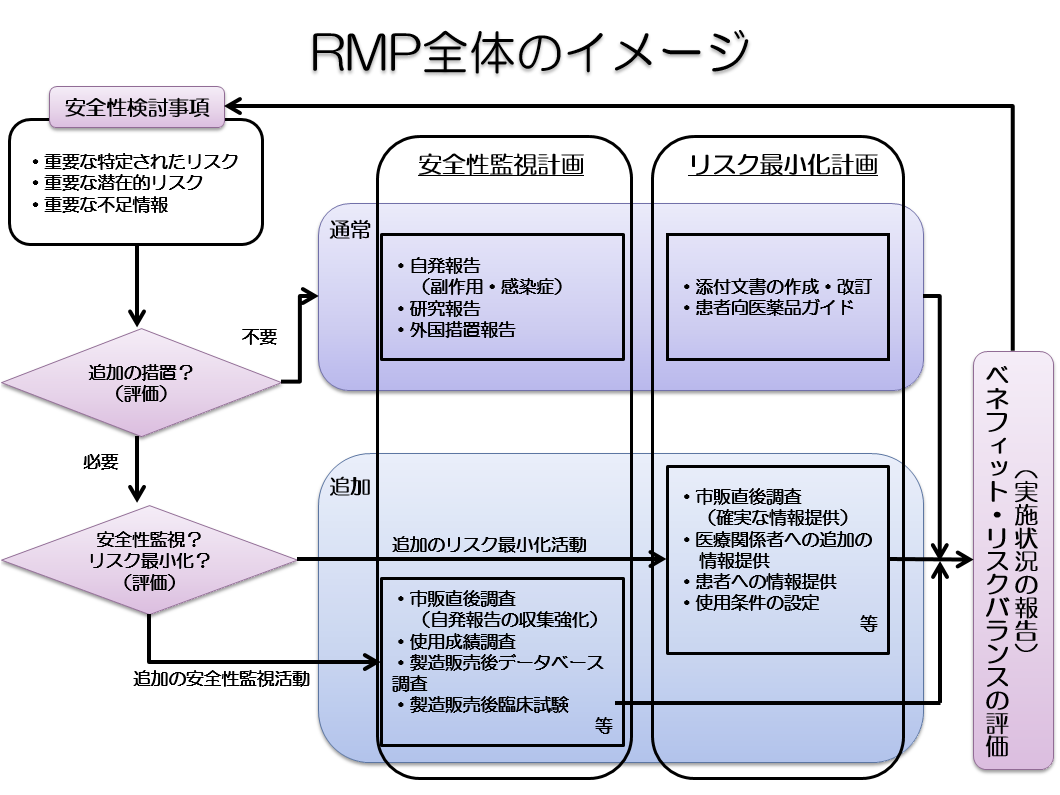
RMPの概要
RMPとは、個別の医薬品ごとに、(1)重要な関連性が明らか、又は疑われる副作用や不足情報(安全性検討事項)、(2)市販後に実施される情報収集活動(医薬品安全性監視活動)、(3)医療関係者への情報提供や使用条件の設定等の医薬品のリスクを低減するための取り組み(リスク最小化活動)をまとめた文書です。 医薬品安全性監視活動とリスク最小化活動には、「通常」と「追加」の2種類の活動があり、「通常の活動」とは、全ての医薬品に共通して製造販売業者が実施する活動のことで、具体的には、副作用情報の収集、添付文書による情報提供などが該当します。一方、「追加の活動」とは、医薬品の特性を踏まえ個別に実施される活動のことで、市販直後調査、使用成績調査、製造販売後臨床試験、適正使用のための資材による情報提供などが該当します。 承認審査等の過程で「追加の活動」の実施が必要と判断された場合には、その内容を含むRMPが製造販売業者からPMDAに提出され、PMDAのウェブサイトで公開されます。 医薬品リスク管理計画の構成要素を示した画像は以下のとおりです。
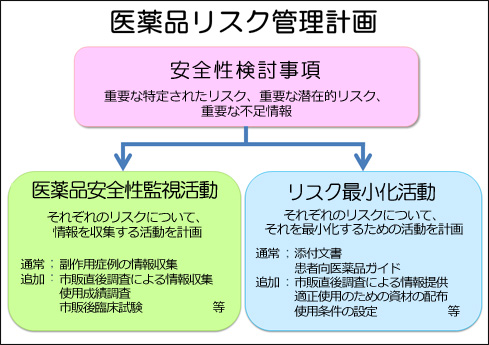
関連資料
関連通知等 | 通知番号等 | 表題 | |—|—| | 2024年6月28日 事務連絡 各都道府県衛生主管部(局)宛 | 医薬品リスク管理計画(RMP)における追加のリスク最小化活動のために作成・配布する資材への表示について(RMPマークの変更等)1.90MB | | 2024年6月20日 事務連絡 各都道府県衛生主管部(局)薬務主管課宛 | 医薬品リスク管理計画に関する質疑応答集(Q&A)の一部改訂について492.20KB | | 令和5年3月15日 事務連絡 | 再審査終了時点におけるRMP掲載のための資料提出について155.34KB | | 令和4年12月26日 事務連絡 | 医薬品リスク管理計画書(RMP)の提出方法について144.08KB | | 令和4年9月30日 事務連絡 | バイオ後続品の承認条件解除時におけるRMP掲載のための資料提出について162.95KB | | 令和4年9月30日 事務連絡 各都道府県衛生主管部(局)薬務主管課宛 | 医薬品リスク管理計画に関する質疑応答集(Q&A)の一部改訂について605.15KB (注)2024年6月20日一部改正 | | 令和4年3月18日 事務連絡 | 医薬品リスク管理計画書(RMP)の提出方法について147.96KB (注)令和4年12月26日関連事務連絡発出 | | 令和4年3月18日 薬機安企発第0318001号 | 医薬品リスク管理計画書の公表資料及び追加のリスク最小化活動として作成・提供する資材の公表に関する留意点について344.92KB | | 令和4年3月18日 事務連絡 各都道府県衛生主管部(局)宛 | 医薬品リスク管理計画に関する質疑応答集(Q&A)について204.76KB (注)令和4年9月30日一部改正 (注)2024年6月20日一部改正 | | 令和4年3月18日 薬生薬審発0318第2号 薬生安発0318第1号 | 医薬品リスク管理計画の策定及び公表について204.76KB別紙様式49.5KB | | 令和3年3月18日 薬機安企発第0318001号 (平成30年10月29日 薬機安一発第1029001号を改正 | 「医薬品リスク管理計画書の公表資料及び追加のリスク最小化活動として作成・提供する資材の公表に関する留意点について」の一部改正について147.16KB参考:改正後全文231.77KB (注)令和4年5月1日廃止 | | 令和元年5月10日 事務連絡 日本製薬団体連合会宛 | 医薬品リスク管理計画書の軽微変更時の資料作成の留意点(Q&A)について97.52KB (注)令和4年5月1日廃止 | | 平成30年10月29日 薬生薬審発1029第1号 薬生安発1029第1号 (平成25年3月4日 薬食審査発0304第1号 薬食安発0304第1号を改正) | 「医薬品リスク管理計画書の公表について」の一部改正について208.29KB参考:改正後全文146.30KB (注)令和4年5月1日廃止 | | 平成30年10月29日 薬機安一発第1029001号 日本製薬団体連合会安全性委員会委員長殿宛 (令和3年3月18日 一部改正) | 医薬品リスク管理計画書の公表資料及び追加のリスク最小化活動として作成・提供する資材の公表に関する留意点について149.98KB (注)令和4年5月1日廃止 | | 平成30年3月2日 薬生安発0302第1号 | 「医薬品リスク管理計画の実施に基づく再審査期間終了後の評価報告について」の一部改正について142.42KB参考:改正後全文225.08KB | | 平成29年12月5日 薬生薬審発1205第1号 薬生安発1205第1号 (平成24年4月26日 薬食審査発0426第2号 薬食安発0426第1号を改正) | 「医薬品リスク管理計画の策定について」の一部改正について277.67KB (注)令和4年5月1日廃止(参考:医薬品リスク管理計画の策定について)318.99KB別紙様式27.4KB | | 平成29年12月5日 事務連絡 各都道府県衛生主管部(局)宛 | 医薬品リスク管理計画に関する質疑応答集(Q&A)について310.74KB (注)令和4年5月1日廃止 | | 平成29年6月8日 事務連絡 各都道府県衛生主管部(局)宛 | 医薬品リスク管理計画(RMP)における追加のリスク最小化活動のために作成・配布する資材への表示について720.02KB (注)2024年6月28日関連事務連絡発出 | | 平成28年7月29日 事務連絡 各都道府県衛生主管部(局)宛 | 医薬品リスク管理計画に関する質疑応答集(Q&A)その4について205.74KB (注)平成29年12月5日廃止 | | 平成28年4月11日 薬機安一発第0411001号 日本製薬団体連合会安全性委員会委員長殿宛 | 「医薬品リスク管理計画書の公表資料等の提出時の留意点について」の一部改訂について146.83KB参考:改正後全文171.05KB別紙様式27.9KB (注)令和3年3月18日廃止 | | 平成28年3月31日 薬生審査発0331第13号 薬生安発0331第13号 各都道府県衛生主管部(局)長殿宛 | 医薬品リスク管理計画書の概要の作成及び公表について143.88KB別紙様式79.0KB (注)令和4年5月1日廃止 | | 平成26年8月26日 薬食審査発0826第3号 薬食安発0826第1号 各都道府県衛生主管部(局)長殿宛 | 医薬品リスク管理計画指針の後発医薬品への適用等について86.81KB (注)令和4年5月1日廃止 | | 平成25年12月25日 事務連絡 各都道府県衛生主管部(局)長殿宛 | 医薬品リスク管理計画に関する質疑応答集(Q&A)その3について115.96KB (注)平成29年12月5日廃止 | | 平成25年12月20日 薬食安発1220第14号 各都道府県衛生主管部(局)長殿宛 | 医薬品リスク管理計画の実施に基づく再審査期間終了後の評価報告について304.54KB (注)平成30年3月2日改正 | | 平成25年3月11日 薬食発0311第7号 各都道府県知事殿宛 | 医薬品、医薬部外品、化粧品及び医療機器の製造販売後安全管理の基準に関する省令及び医薬品の製造販売後の調査及び試験の実施の基準に関する省令の一部を改正する省令の施行について128.04KB | | 平成25年3月6日 事務連絡 各都道府県衛生主管部(局)長殿宛 | 医薬品リスク管理計画に関する質疑応答集(Q&A)その2について185.17KB (注)平成29年12月5日廃止 | | 平成24年9月7日 事務連絡 各都道府県衛生主管部(局)長殿宛 | 医薬品リスク管理計画に関する質疑応答集(Q&A)について272.15KB (注)平成29年12月5日廃止 | | 平成24年4月11日 薬食安発0411第1号 薬食審査発0411第2号 各都道府県衛生主管部(局)長殿宛 | 医薬品リスク管理計画指針について314.26KB |
その他
- 医薬品・医療機器等安全性情報No.3672.07MB
- 医薬品・医療機器等安全性情報No.3342.04MB
- 医薬品・医療機器等安全性情報No.324830.72KB
- 医薬品・医療機器等安全性情報No.3001.73MB
- パブリックコメント 医薬品リスク管理計画ガイダンス(案)に対するご意見募集の結果について256.57KB (2012年07月03日)
医薬品リスク管理計画書 記載事例
留意点
以下に示す記載事例は、「医薬品リスク管理計画の策定及び公表について」(令和4年3月18日付け薬生薬審発0318第2号、薬生安発0318第1号厚生労働省医薬・生活衛生局医薬品審査管理課長、医薬安全対策課長連名通知)の別紙様式1(医薬品リスク管理計画書)、別紙様式2(医薬品リスク管理計画書の概要)及び別紙様式3(提出届)の表記方法の参考のために、例示として示すものです。安全性検討事項が本記載事例に挙げられているものと同じだとしても、必ずしも安全性監視活動及びリスク最小化活動について本記載事例と同じになるとは限りません。実際の策定の際には適応症、使用患者群など医薬品の特徴に応じて特定される安全性検討事項に基づき策定する必要があります。
- 新医薬品・バイオ後続品の記載事例419.96KB
- 後発医薬品の記載事例318.16KB
- 医薬品リスク管理計画書の概要の記載事例120.13KB
- 提出届の記載事例91.42KB
FAQ
At riskの使い方は?
at riskの例文 何千もの家族が、家賃を払えないせいで立ち退きの危機にある。 People who are overweight are at risk of having heart problems. 太りすぎの人たちは心臓に問題を抱える危険性が
英語で「Risk O to do」の意味は?
〖S risk O《to do》〗 主語が目的語を危険にさらす《〜するために》 He risked his life to save her. 彼は彼女を救うために命をかけた。
What is the lore behind Buckshot Roulette?
The story and lore of Buckshot Roulette revolves around a seedy nightclub, where, in a backroom, the player, down on their luck and in need of money, agrees to play a game with an entity known as The Dealer. Success, according to the Waiver you sign before playing reveals that success will net the player $10,000.Apr 16, 2024
Buckshot Rouletteはどんなゲームですか?
『Buckshot Roulette』は、プレイヤーとディーラーでショットガンを使ったロシアンルーレットを行い、生き残ることで賞金を手に入れら
How long does it take to beat Buckshot Roulette?
When focusing on the main objectives, Buckshot Roulette is about 25 Mins in length. If you’re a gamer that strives to see all aspects of the game, you are likely to spend around 4 Hours to obtain 100% completion.
Is Buckshot Roulette really random?
Yes, they randomize, which means, yes you can get very unlucky. Though I never hear people who have all the skill or all the RNG manipulation hacks complaining DoN is too unfair.30 Apr 2024
Where can I find the Buckshot Roulette game?
Buckshot Roulette is a 2023 indie tabletop horror video game developed and published by Mike Klubnika on itch.io. It was released on Steam by Critical Reflex on April 4, 2024, to coincide with a new update.
Literally Mindblowing Gameplay. 15 to 20-minute intense playtime. Enter the arena, go three rounds against The Dealer, and walk away with the prize.
This site only collects related articles. Viewing the original, please copy and open the following link:医薬品リスク管理計画(RMP:Risk Management Plan) 独立行政法人 医薬品医療機器総合機構





























































































































































